
デュシェンヌ型筋ジストロフィー治療に新たな光 -–– 脂質ナノ粒子を使ったゲノム編集
T-CiRA’s Science Series
幼児の頃から筋肉の萎縮が始まり、次第に進行する難病「デュシェンヌ型筋ジストロフィー」は、ジストロフィン遺伝子の変異が原因で起こります。最近、核酸医薬、遺伝子治療、ゲノム編集などの新しい技術で遺伝子の機能を回復させる治療法が開発されています。T-CiRAでは、ゲノム編集に必要なツールを独自開発の脂質ナノ粒子に入れて骨格筋細胞に送り届ける治療法を開発しました。これまでの治療法の弱点を克服するものであり、効果が1年にわたって持続することをマウスで確認しました。
ジストロフィン遺伝子を回復させる根本治療
筋ジストロフィーは、全身の筋肉に進行性の障害が生じる国の指定難病です。なかでもデュシェンヌ型筋ジストロフィー(DMD)はジストロフィン遺伝子の変異が原因で起こり、最も重症で、患者数の多い疾患です。
ジストロフィン遺伝子はX染色体上にあるため、DMDを発症するのは男児で、出生男児3500人に1人の割合で見られます。患者さんは遺伝子の変異により、筋肉の構造を保つのに必要なジストロフィンというタンパク質をまったくもしくは少ししかつくれません。このため、幼児期から歩行異常や頻繁な転倒などの症状が現れ、やがて身体を動かしにくくなり、呼吸器や心臓の機能低下に進みます。対症療法によって平均寿命は少しずつ伸びていますが、30歳を超えて生存する患者さんはなお多くないのが現状です。
そこで期待されているのが、遺伝子の機能を回復させ、ジストロフィンをつくれるようにする根本的な治療法です。2020年には「核酸医薬による治療」がわが国でも承認され、「ウイルスベクターを用いる遺伝子治療」が臨床試験中であり、さらに、「ゲノム編集による治療」についても研究開発が進んでいます。
独自開発の脂質ナノ粒子で問題点を克服
しかし、これらの新しい治療法はいずれも患者さんにとっていくつかの問題点を抱えています。核酸医薬による治療は、核酸の半減期が短く、体内ですぐに消滅するため、患者さんは毎週1回、生涯にわたって点滴を受けなければなりません。遺伝子治療では、ウイルスベクターにジストロフィン遺伝子を載せて変異のある筋細胞に導入し、ジストロフィンをつくらせますが、ウイルスベクターに対する免疫反応が生じるため、1回遺伝子を投与した後は再投与ができません。ゲノム編集による治療は、ウイルスベクターによって、ゲノム編集に必要なツール(後述の酵素など)を筋細胞に導入して治療する方法が開発中ですが、上と同じ理由で治療は1回限りです。
これらの問題点を克服する方法を求めて、T-CiRAでは、DMDを治療する安全で効果的な方法の開発に取り組んできました。具体的には、ゲノム編集による治療において、免疫反応を引き起こすウイルスベクターを使わずに必要なツールを筋細胞に送り届けることを目指してきたのです。
研究グループが新たな送達手段として独自開発したのが、4種類の脂質成分からできた脂質ナノ粒子(LNP)です(図1)。LNPの中にゲノム編集に必要なツールを入れておけば、細胞に到達した後、細胞内の酸性環境でツールが放出されて機能を発揮します。
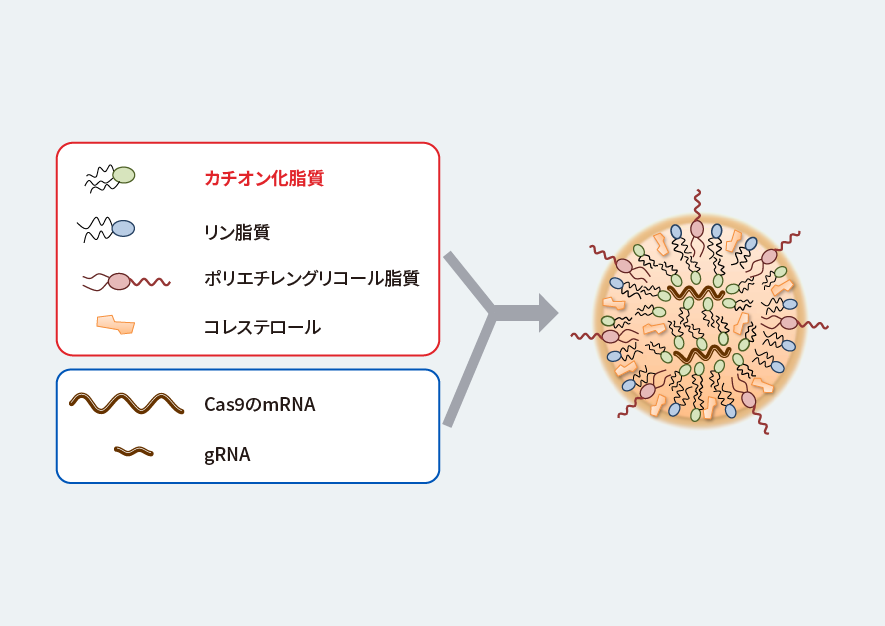
図1 独自開発の脂質ナノ粒子(LNP)
ゲノム編集ツール(Cas9のmRNAとgRNA)を入れ、筋細胞に送達する。
Kenjo, E., Hozumi, H., Makita, Y. et al. Low immunogenicity of LNP allows repeated administrations of CRISPR-Cas9 mRNA into skeletal muscle in mice. Nat Commun 12, 7101 (2021). https://doi.org/10.1038/s41467-021-26714-wのFig. 1aを改変。
ゲノム編集によるDMDの治療とは
そもそもDMDはどのような仕組みで起こるのでしょうか。ジストロフィン遺伝子からつくられるmRNAは79個のエクソン(タンパク質合成情報をコードする部分)がつながったもので、これをもとにジストロフィンがつくられます。ところが、DMDの患者さんでは一部のエクソンが欠損していたり重複していたりするために、エクソンがうまくつながらなくなり、ジストロフィンがつくれなくなっているのです。
そこで考えられたのが、「エクソンスキッピング」という方法です。つながりを悪くしているエクソンをスキップし(取り除いてしまい)、その前後のエクソンをつなぐことで、ジストロフィンをつくれるようにします。こうしてできるジストロフィンは正常のものよりやや短めですが、筋肉の構造を保つ機能は維持しているので、症状を軽くする治療効果が期待できます。
ゲノム編集によるDMDの治療では、ジストロフィン遺伝子のうち問題のエクソンに対応する部分を切り取ることで、mRNAにエクソンスキッピングを起こさせます。ゲノム編集とは遺伝子の中の狙った部分を切断する方法で、必要なツールは分解酵素Cas9のmRNAとガイドRNA(g RNA)です。ジストロフィン遺伝子中の切断すべき部位をg RNAが認識し、Cas9が切断を実行します。
効果が持続する新しいゲノム編集治療
DMDを引き起こすジストロフィン遺伝子の変異にはいろいろな種類があります。その一つとしてエクソン44(44番目のエクソン)の欠損があり、エクソン43と45のつながりが悪くなって、ジストロフィンがつくれなくなっています。この場合、エクソン45をスキップすると、エクソン43と46がうまくつながって、ジストロフィンをつくれるようになります。
研究グループでは、エクソン44が欠損しているDMDのモデルマウスを作製し、開発したLNPを用いてゲノム編集による治療実験を試みました(図2)。LNPに搭載したのは、Cas9のmRNAと、遺伝子中のエクソン45の前を認識するgRNAと後を認識するgRNAです。これらを筋細胞に送り込み、エクソン45の前後2カ所を切断することで、このエクソンを取り除こうとしたのです。
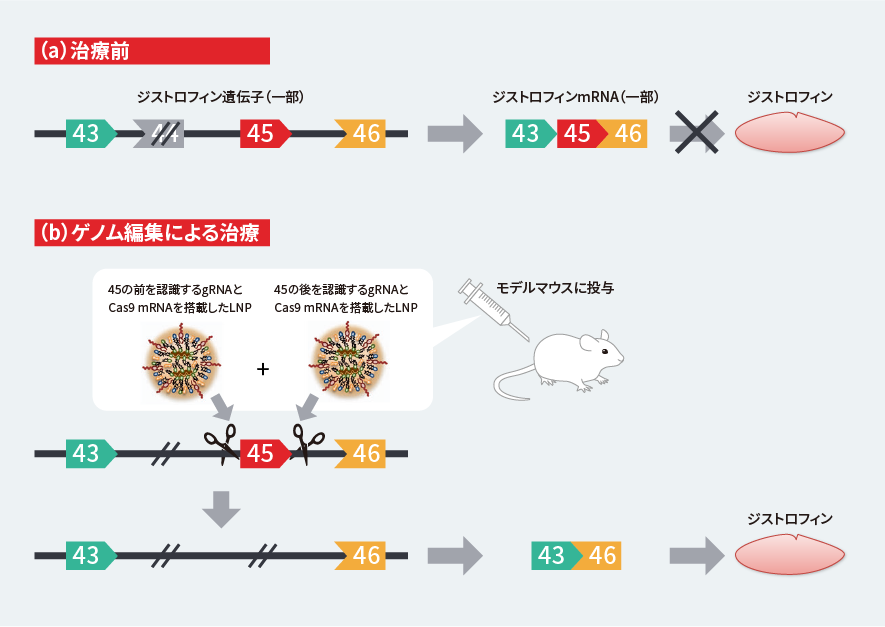
図2 LNPを用いたゲノム編集による治療実験
(a)遺伝子中でエクソン44に対応する部分が欠損しているDMDでは、mRNAのエクソンのつながりが悪く、ジストロフィンをつくれない。(b)この欠損をもつモデルマウスにCas9のmRNAと2種類のgRNAをそれぞれ加えたLNPを注射して、ゲノム編集を行う。ジストロフィン遺伝子中のエクソン45に対応する部分を前後で切り取ることで、mRNAではエクソン45を飛ばしてエクソン43が46と結合するエクソンスキッピングが実現し、ジストロフィンをつくれるようになる。
Kenjo, E., Hozumi, H., Makita, Y. et al. Low immunogenicity of LNP allows repeated administrations of CRISPR-Cas9 mRNA into skeletal muscle in mice. Nat Commun 12, 7101 (2021). https://doi.org/10.1038/s41467-021-26714-wのFig. 2bとFig. 4aを改変。
結果はねらい通りで、エクソンスキッピングが起こり、ジストロフィンがつくられていました。しかも、1回の投与で、ジストロフィンがつくられる状態が少なくとも1年間持続していることが確かめられました。これに対し、核酸医薬を投与した場合は効果が1ヵ月ほどしか持続しませんでした。また、LNPを用いた場合、繰り返し投与が可能で、効果が蓄積されることも確かめました。さらに、筋肉に直接投与するのではなく、結紮した血管内に投与すればより広い範囲の骨格筋に効果が及ぶこともわかりました。
今後は、寿命の長いモデル動物でさらに長期の効果を調べる、LNPを改良して効果の及ぶ範囲を広げるなどの研究開発を進めます。LNPを用いることで、定期的に注射をするだけでジストロフィンをつくれる、安全で確実なDMDの治療法を完成させることが目標です。