
進行性肝細胞がんに対するCabozantinibの第2相試験
情報作成日:2023年3月17日
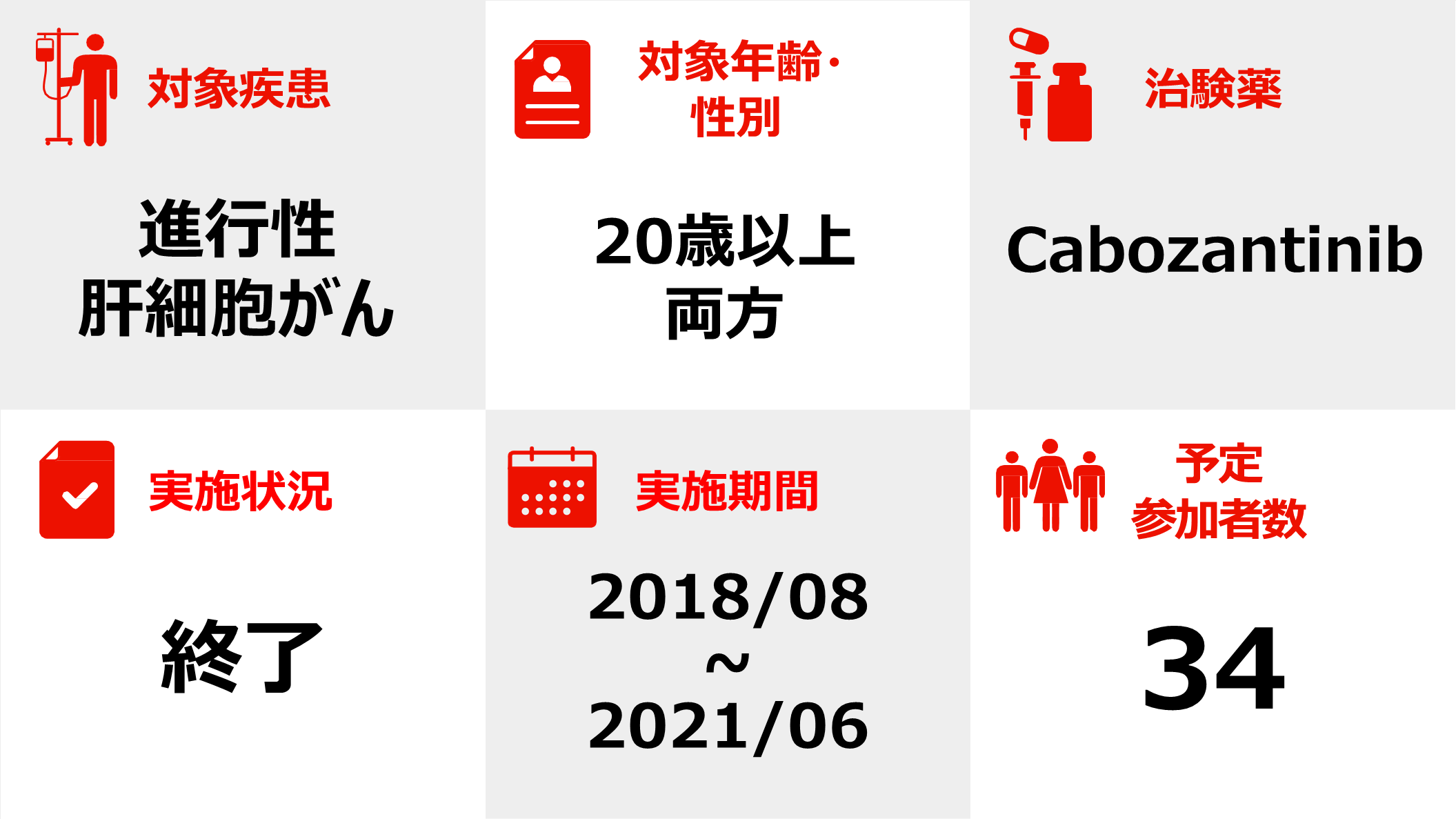
この臨床試験の対象となりえる方(主な項目*)
・病理検査で肝細胞がんと診断されている方
・肝移植、外科的切除などの根治的治療の適応とならない方
・進行性肝細胞がんに対してこれまでに1種類又はそれに続いて2種類目の化学療法を受けており、がんの進行が確認された方
・日常生活に大きな支障がない方
*こちらに記載された項目以外にも多くの基準があります。
この臨床試験の対象とならない方(主な項目*)
・線維(せんい)層状型(そうじょうがた)、または肝細胞がんと肝内胆管がんの混合型と診断された方
・治験薬を飲み始める前14日以内に抗悪性腫瘍作用を有する薬剤を使用されたことがある方
・治験薬を飲み始める前14日以内に骨転移に対して放射線療法を受けた方、治験薬を飲み始める前28日以内にその他の外照射療法を受けた方。治験薬を飲み始める前42日以内に放射線による全身療法を受けた方。過去に受けた放射線療法により、臨床的に問題がある合併症が残っている方
*こちらに記載された項目以外にも多くの基準があります。
この臨床試験の実施医療機関
*医療機関の情報については掲載について了承いただいた施設から掲載していきます。
|
医療機関の名称 |
住所 |
参加者募集状況 |
|
この臨床試験の参加の募集は終了しました。 |
臨床試験の概要
この臨床試験は、Cabozantinibを治験薬として、進行性肝細胞がんの患者さんを対象に行われます。
この臨床試験では、治験薬Cabozantinib 60 mgの錠剤を1日1回服用いただきます。
臨床試験に参加中は実施されている医療機関に複数回来院いただくことになります。
臨床試験の詳細情報
この臨床試験の情報は以下のウェブサイト(外部サイト)でもご覧いただけます。以下のIDや番号で検索するとこの臨床試験の詳細情報を確認できます。
・jRCT(日本語)
jRCT番号 : jRCT2080223960
(「JapicCTI-184018」でも検索できます)
・ClinicalTrials.gov(英語)
ClinicalTrials.gov番号 : NCT03586973
臨床試験の結果
この臨床試験の結果は、臨床試験が終了した後にタケダのポリシーに基づき、以下のサイトで掲載します。
臨床試験情報専用サイト TakedaClinicalTrials.com
お問い合わせ先
この臨床試験情報に関するお問い合わせはこちらのフォームまでお願いします。
*臨床試験への参加のご要望や病気のご相談などは薬事関係法令上、受け付けていませんので主治医の先生にご相談ください。
